|
|
Charlotte Toftmann Hansen
1.reservelæge, ph.d-stud. Hæmatologisk afdeling X Odense Universitetshospital
|
Inden for de senere år er der blevet introduceret en ny måling til gavn for myelomatose patienter, nemlig analysen serum frie lette kæder.
Serum frie lette kæder analysen er et særdeles interessant supplement til de diagnostiske redskaber vi allerede kender i dag. Der er flere mulige fordele ved at bruge denne analyse i både diagnostikken og opfølgningen af myelomatose patienter, hvilket jeg vil fortælle om i det følgende. Der vil først være en gennemgang af, hvad de frie lette kæder er, dernæst hvilke mulige fordele, der er ved at bruge analysen og sidst hvilken betydning de har for den enkelte patient.
en gennemgang af, hvad de frie lette kæder er, dernæst hvilke mulige fordele, der er ved at bruge analysen og sidst hvilken betydning de har for den enkelte patient.
Sygdommen myelomatose
Ved myelomatose er det en såkaldt plasmacelle fra knoglemarven, der er blevet til en cancercelle. Den normale plasmacelle danner antistoffer, også kaldet immunglobuliner. Antistofferne er vigtige i bekæmpelsen af infektioner. Der findes forskellige typer plasmaceller, der hver danner én type immunglobulin.
Ved myelomatose duplikeres en type plasmacelle mange gange (kaldet en klon). Derved dannes der en stor mængde af én bestemt type immunglobulin, kaldet M-komponent.
Hvad er serum frie lette kæder?
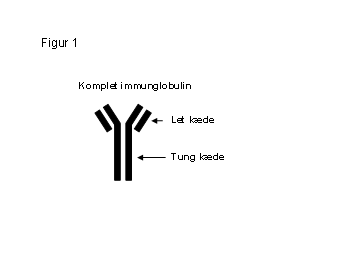
Et normalt immunglobulin er symmetrisk opbygget af 2 ens større kæder (tunge kæder) og 2 ens mindre kæder (lette kæder). Se figur 1. Som tidligere nævnt, er der forskellige typer af tunge kæder, mens der kun er 2 typer lette kæder, disse kaldes ”kappa” (κ) og ”lambda” (λ).
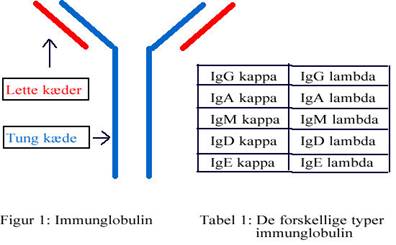
De tunge og lette kæder dannes adskilt inde i plasmacellen, herefter samles de og danner et intakt immunglobulin, som kan frigives til blodet. Når de lette kæder er bundet til de tunge kæder omtaler vi dem som bundne lette kæder. I plasmacellen dannes der, af ukendte grunde, et overskud af lette kæder, hvilket betyder at en del af de lette kæder vil frigives til blodet uden at være bundet i et komplet immunglobulin. Disse lette kæder omtales som de frie lette kæder. Det vil sige, at det er helt normalt at have en vis koncentration af frie lette kæder i blodet. Det, der er afgørende for om det anses for normalt eller sygeligt er, hvor mange frie lette kæder der er til stede i blodet, samt forholdet mellem de 2 kæder, kappa og lambda.
Under normale forhold er der et ligeligt forhold mellem de 2 kæder, men er der tale om klonal (malign, ondartet) sygdom ændres dette forhold i abnorm retning. I tabel 2 er det normale niveau af frie lette kappa kæder, frie lette lambda kæder, samt forholdet mellem de 2, benævnt kappa/lambda ratioen, vist.
- Kappa: 3,3 – 19,4 mg/l
- Lambda: 5,71 – 26,3 mg/l
- Kappa/lambda ratio: 0,26 – 1,65
Tabel 2. Det normale niveau af serum frie lette kæder i blodet.
De lette kæder nedbrydes i nyren. De lette kæder er så små, at de kan passere gennem de filtre i nyrerne, som adskiller blodet fra urinen. Hos patienter, hvor produktionen af lette kæder er høj, vil der derfor ”svømme” lette kæder over i urinen, mens der hos raske personer normalt ikke findes frie lette kæder i urinen. Denne form for myelomatose omtales normalt som let kæde myelomatose. Disse patienters sygdom har normalt været fulgt ved at måle M-komponent i urinen ved en såkaldt protein elektroforese. Det er imidlertid både nemmere og mere nøjagtigt at følge disse patienter ved at måle niveauet af serum frie lette kæder.
Dette skyldes primært at indholdet af frie lette kæder i urinen er meget afhængig af nyrefunktionen. Nyrefunktionen er ofte påvirket ved myelomatose. Ved nedsat nyrefunktionen vil mængden af lette kæder i urinen også blive lavere, fordi nyrerne ikke tillader så mange kæder at svømme over i urinen. Ved kun at måle på M-komponenten i urinen (altså Bence Jones lette kæder) vil man derfor kunne få et falskt indtryk af tilstanden. Måling direkte på de lette kæder i blodet er desuden langt hurtigere følsom for sygdomsændringer, idet blot en lille stigning i produktionen af lette kæder vil kunne bestemmes med det samme. For at kunne måle lette kæder i urinen skal produktionen overskride nyrens evne til at tilbageholde de lette kæder. Denne evne overskrides først, når produktionen er steget mere end 10-30 gange det normale.
Testen ”serum frie lette kæder” er i stand til at måle frie lette kæder i deres normale niveau i blodet. Disse test kan derfor måle selv små stigninger i niveauet af lette kæder, hvilket normalt ikke er målbart med de analyser, vi ellers har og bruger i dag til måling af M-komponenten, nemlig serum protein elektroforese og immunfixationselektroforese. De lette kæder i blodet kan ved serum frie lette kæder analysen påvises ved få milligram, hvorimod protein elektroforesen kræver M-komponent koncentrationer på 1-2 gram i blodet for at kunne påvises.
De lette kæder i blodet kan ved serum frie lette kæder analysen påvises ved få milligram, hvorimod protein elektroforesen kræver M-komponent koncentrationer på 1-2 gram i blodet for at kunne påvises.
Serum frie lette kæder analysen: normal versus abnorm
Myelomceller danner kun en type let kæde, enten kappa eller lambda, afhængig af hvilken type myelomatose der er tale om. Det vil sige, at hvis, der er tale om myelomatose, der danner kappa kæder, vil koncentrationen af kappa kæder i blodet stige. Hvis derimod, det er lambda kæder der dannes vil koncentrationen af disse kæder stige. Derfor bruger man forholdet mellem de 2 kæder til at afgøre om, der er tale om klonal, altså malign, sygdom eller ej. Er koncentrationen af en af de 2 kæder høj, og den anden normal eller lav, vil det medføre en skæv ratio.
Selve forholdet mellem de 2 kæder, kappa/lambda ratioen er derfor det grundlæggende redskab i diagnostikken, frem for de respektive koncentrationer.
Selve forholdet mellem de 2 kæder, kappa/lambda ratioen er derfor det grundlæggende redskab i diagnostikken
Vi ved, at man kan se forhøjet koncentration af frie lette kæder ved andre sygdomme/tilstande end myelomatose. Det ses for eksempel ved nedsat nyrefunktion, hvor niveauet af frie lette kæder stiger, fordi nyrerne ikke er i stand til at udskille så mange lette kæder. Der sker en ensartet ophobning af kappa og lambda kæder, således at forholdet mellem de 2 kæder, kappa/lambda-ratioen forbliver normal. Man kan også se det, når immunforsvaret er aktivt, som ved infektion og inflammatoriske tilstande (gigtsygdomme og visse tarmsygdomme), da vil der generelt være en aktivering af plasmaceller og derfor en øget produktion af lette kæder. Ved disse tilstande vil der imidlertid være en ligelig aktivering af både kappa og lambda producerende plasmaceller, og fordeling af de 2 frie lette kæder, kappa og lambda, udtrykt ved kappa/lambda-ratioen vil derfor bevares indenfor de normale grænser.
Kappa/lambda ratioen er også et vigtigt redskab hos myelomatose patienter efter at diagnosen er stillet. På diagnose-tidspunktet anbefales det alle patienter at få taget denne prøve, idet en normal ratio formentlig peger i retning af et særligt gunstigt forløb.
Har man forud for behandlingen haft en skæv ratio, er det vigtigt igen at måle denne efter endt behandling. Er ratioen da blevet normaliseret, benævner man dette stringent komplet remission, hvilket er en specielt god form for sygdomskontrol. Normaliseringen af kappa/lambda ratioen efter behandling tyder sandsynligvis på en længere sygdomsfri periode.
Hvornår kan serum frie lette kæder analysen gøre sig gældende i forhold til behandling?
1. Analysen kan betyde, at man tidligere kan vurdere behandlingseffekt samt sygdomsforværring.
Ændringer i niveauet af serum frie lette kæder i blodet ændrer sig hurtigere end M-komponenten, fordi de mindre lette kæder har en hurtigere omsætningstid. Man forventer at ændringer i frie lette kæder vil ske indenfor dage, hvorimod ændringer i M-komponenten, ikke kan forventes, før der er gået 1-3 uger.
2. Monitorering (dvs. overvågning og opfølgning) af patienter med lavt niveau af M-komponent.
Denne form for myelomatose kaldes også non-sekretorisk. 70-80 % af disse patienter, der med de tidligere kendte diagnostiske redskaber (blod- og urinprøve) ikke havde målbar sygdom, vil udvise abnormalitet svaende til niveauet af de frie lette kæder, hvilket gør denne analyse særdeles attraktiv hos netop denne patient gruppe, der tidligere har måttet i gennem utallige knoglemarvs undersøgelser for at følge udviklingen i sygdommen.
3. Monitorering af patienter med let kæde myelomatose.
Alle patienter med let kæde myelomatose har abnorm koncentration af frie lette kæder i blodet. Det er væsentligt nemmere at monitorere disse patienter med en blodprøveanalyse, frem for døgn-urin opsamling, der er tidsrøvende og besværligt for både patient og laboratorium, og som nævnt tidligere, kan være behæftet med fejl eller mangler. Endvidere er blodprøven mere følsom, idet en lille stigning i serum frie lette kæder ofte ikke vil kunne ses i en urinprøve, men derimod ikke vil bliver overset med blodprøven.
4. Bestemmelse af stringent komplet remission efter behandling.
Hvis kappa/lambda ratioen bliver normal efter behandling er dette en særdeles god og følsom markør for, at behandlingen har været yderst effektiv. Det betyder, at mængden af M-komponent er nedsat så meget, som det er muligt. Opnår man en normalisering af kappa/lambda ratioen taler man om stringent komplet remission. Dette er det bedst mulige respons man kan opnå. Stringent komplet remission inkluderer også en normalisering af protein elektroforesen, en normal urin protein elektroforese, en normal immunfiksation og fravær af myelom celler i knoglemarven.
Har det en skadelig effekt at have en høj koncentration af frie lette kæder i blodet?
Hvis man i blodet har en højere koncentration af frie lette kæder end normalt er der risiko for at disse kan have en skadelig effekt. Med vores nuværende viden kender vi ikke noget præcis mål for, hvornår koncentrationen er høj nok til at forårsage skadevirkning.
De lette kæder, der som tidligere nævnt er små molekyler kan binde sig forskellige steder i kroppen og forårsage sygdom. Vi taler om at de aflejres, hvorfor det også benævnes aflejringssygdomme. De frie lette kæder kan aflejres i forskellige organer, typisk kan de binde sig til nyrer, hjerte, lever og tarm. Alle steder medfører det organpåvirkning, med nedsat funktion af det pågældende organ.
De lette kæder kan også aflejres i nerveskederne, medførende nervebetændelse, også kaldet polyneuropati, en ubehagelig tilstand, hvor man har snurrende eller sovende fornemmelser i hænder eller fødder. Disse symptomer vil dog hyppigere ses som en bivirkning til selve behandlingen af myelomatosen.
Man har i dag mulighed for akut at fjerne de frie lette kæder fra blodet, ved en speciel form for dialyse. Det, der er specielt ved dialysen, er, at der bruges et bestemt filter til at rense blodet. Det vil man gøre i de tilfælde, hvor der er en meget høj koncentration af frie lette kæder, samtidig med at nyrefunktionen er påvirket. På denne måde kan man nedsætte sandsynligheden for permanente skader på nyrerne og dermed livslang dialyse. At fjerne de frie lette kæder fra blodet er en symptomatisk behandling, det vil sige, man forsøger at begrænse skadevirkningerne af myelomatosen. Det er ikke en behandling af selve myelomatosen, idet man ikke påvirker de syge celler, som er årsagen til denne overproduktion af lette kæder. Dialysebehandlingen kan altså ikke stå alene.
Har niveauet af frie lette kæder i blodet nogen betydning?
Både ja og nej!
Vi ved på nuværende tidspunkt ikke, hvornår en forhøjet koncentration af frie lette kæder er farlig, og der er derfor ikke fastlagt noget niveau for at påbegynde behandling blot ud fra niveauet af frie lette kæder.
Vi ved også, at niveauet af frie lette kæder i blodet er forskellig fra patient til patient. Som regel er niveauet af kappa højere end niveauet af lambda. Umiddelbart kan man ikke ud fra koncentrationen af frie lette kæder i blodet, sige noget om aktiviteten af myelomatose-sygdommen.
Det er niveauet af frie lette kæder hos den enkelte patient, der er interessant og som skal sammenlignes. Det vil sige, hver enkelt patient er unik og er sin egen reference. Man kigger altså på, hvordan niveauet af frie lette kæder ligger i forhold til tidligere hos den enkelte patient, og sammenligner ikke patienterne i mellem.
Det er således ikke mængden af de frie lette kæder hos den enkelte patient, der siger så meget om aktiviteten i sygdommen, men derimod ændringer i koncentrationen hos den enkelte patient, der er afgørende for hvordan sygdommen udvikler sig og påvirkes af den givne behandling.
Det er heller ikke koncentrationen af frie lette kæder, der er afgørende for, om man påbegynder behandling, men derimod tilstedeværelsen af andre symptomer såsom blodmangel, nyrepåvirkning, knogleskader og patientens almensymptomer i øvrigt, der afgør hvor aktiv sygdommen er og om det er nødvendigt at give behandling eller blot observere sygdommen.